人類微心臟模型助力精細醫療與藥物研發
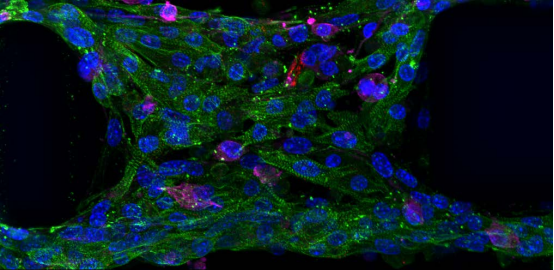
心血管疾病是全球致死率居高不下的重大健康威脅,而傳統動物模型和二維細胞培養在藥物研發中存在預測性差、成本高昂等諸多局限。如今,CELLINK 公司借助 BIONOVA X 的創新技術,成功打造出人類微心臟模型,為精細醫療和藥物發現開辟了全新路徑。
思維導圖
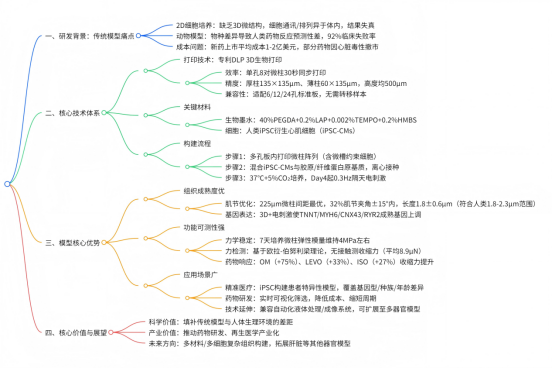
傳統研究模型的困境
長期以來,動物模型和 2D 細胞培養是心血管疾病研究與藥物測試的主要工具,但二者均存在明顯短板。2D 細胞培養缺乏人體組織的三維微結構,細胞間通訊和排列方式與體內真實情況差異較大,導致實驗結果難以反映人體實際反應;動物模型則因物種差異,對人類藥物反應的預測價值有限,據 FDA 數據,約 92% 通過動物實驗的藥物在人體臨床試驗中失敗,新藥上市平均成本高達 10-20 億美元。此外,部分藥物對不同基因型、種族、性別和年齡群體的效果差異***,傳統模型難以覆蓋這些變量。
創新技術:3D 生物打印構建微心臟模型
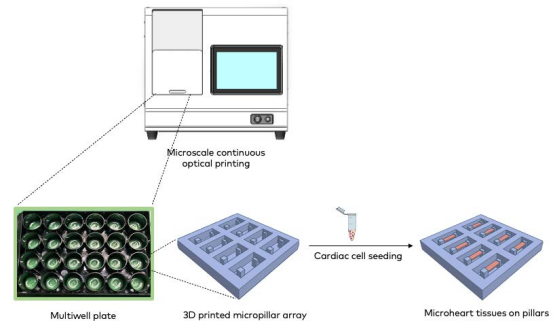
CELLINK 團隊采用**數字光處理(DLP)BIONOVA X生物3D 打印機,在標準多孔板中直接打印出高精度微柱陣列,再接種人類誘導多能干細胞衍生心肌細胞(iPSC-CMs),成功構建出 “微柱上的心臟” 模型。
該技術具有突出優勢:打印速度快,每個孔中 8 對微柱可在 30 秒內同步完成;分辨率高,能精細控制微柱尺寸與間距,厚柱尺寸為 135×135μm,薄柱為 60×135μm,高度均為 500μm;兼容性強,可適配 6 孔、12 孔、24 孔等標準培養板,無需轉移樣本即可直接成像和檢測。更重要的是,打印的微柱在 7 天培養期內力學性能穩定,彈性模量維持在 4MPa 左右,為心肌組織生長提供了可靠的支撐環境。
關鍵突破:優化心肌組織成熟度與功能
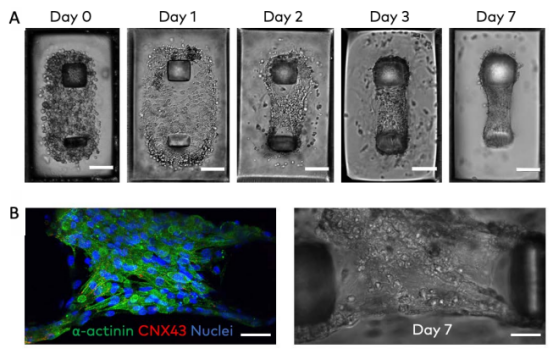
為提升模型的生理相關性,研究團隊從多方面進行了優化。通過測試 100-225μm 不同微柱間距,發現 225μm 間距時肌節排列比較好,32% 的肌節與收縮力方向夾角在 ±15° 以內,49% 在 ±30° 以內,且平均肌節長度為 1.8±0.6μm,完全處于人類心臟肌節的正常工作范圍(1.8-2.3μm)。
同時,結合 3D 培養與電刺激(0.3Hz,自接種后第 4 天開始隔天刺激),***提升了心肌組織的成熟度。與傳統單層培養相比,這種組合方式使肌節力生成相關基因(TNNT、MYH6)、縫隙連接基因(CNX43)和鈣離子通道基因(RYR2)的表達均大幅上調,讓 iPSC-CMs 衍生組織的功能更接近成熟心肌。
實用價值:實時監測藥物反應與收縮力
該微心臟模型可直接在培養板中實現心肌收縮力的無接觸實時測量。利用歐拉 - 伯努利梁理論,通過追蹤薄柱的彎曲位移,即可計算出心肌組織的收縮力,平均收縮力達 8.9μN,與體積大 6 倍的工程化心肌組織相當。
在藥物測試中,模型表現出良好的響應性:經奧美沙坦(OM)、左西孟旦(LEVO)和異丙腎上腺素(ISO)處理后,心肌收縮力分別提升 75%、33% 和 27%,驗證了其在藥物篩選中的實用性。這種實時可視化的檢測方式,為藥物療效評估和心臟毒性檢測提供了高效工具。
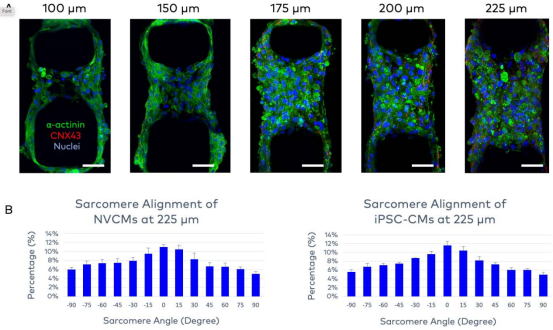
未來展望:賦能精細醫療與再生醫學
該 3D 生物打印微心臟模型的成功構建,不僅解決了傳統模型的諸多痛點,還展現出廣闊的應用前景。依托 iPSC 技術,可從特定患者身上獲取細胞,構建個性化模型,助力罕見病研究和精細治療方案制定;其高通量特性適合大規模藥物篩選,能***降低研發成本、縮短研發周期。
未來,該技術還可擴展到多材料、多細胞復雜組織模型的構建,與自動化液體處理系統、成像系統等集成,進一步提升研究效率。此外,該方法還可推廣到肝臟、腎臟等其他組織模型的構建,為整個精細醫療和藥物研發領域帶來**性變化。


關注我們了解更多
Cellink 認證的中國授權經銷商:

上海跡亞國際商貿有限公司
Gaia China Co.,Ltd.


