拉薩多西他賽
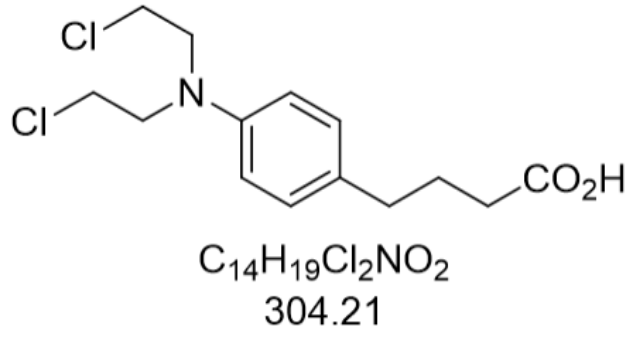
卡巴他賽(Cabazitaxel,CAS: 183133-96-2)作為第二代紫杉烷類微管抑制劑,其化學本質是天然紫杉烷類化合物毒殺酚的半合成衍生物。通過結構優化,該藥物明顯降低了對ATP依賴性外排泵P-糖蛋白1(P-gp)的親和力,同時增強了穿透血腦屏障的能力。在臨床前研究中,小鼠和大鼠模型顯示,當卡巴他賽濃度超過11μM時,其血腦屏障攝取量明顯增加,并在13μM濃度下達到飽和狀態。這一特性使其在轉移性去勢抵抗性前列腺疾病(mCRPC)醫治中展現出獨特優勢,尤其是針對多西他賽醫治失敗后的患者群體。2010年6月,美國FDA批準卡巴他賽聯合潑尼松用于mCRPC的二線醫治,成為延長該類患者生存期的化療藥物。其作用機制通過與微管蛋白高親和力結合,促進微管組裝并阻止其解體,從而阻斷疾病細胞有絲分裂進程。相較于傳統紫杉烷類藥物,卡巴他賽對耐藥疾病細胞的殺傷效果更明顯,臨床研究顯示其可使PSA應答率提升至35.7%,影像學無進展生存期延長至4.4個月。原料藥生產自動化降低人為誤差。拉薩多西他賽
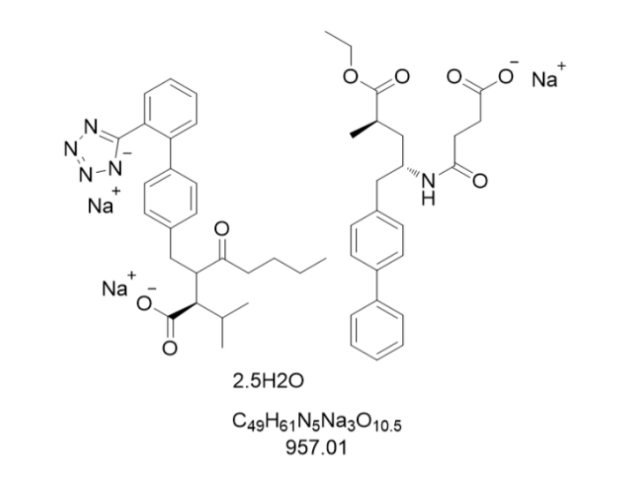
在適應癥拓展與特殊人群應用方面,LCZ696的性能優勢突破了傳統心衰醫治框架。針對亞洲高鹽攝入人群的研究顯示,該藥物對鹽敏感性的降壓效果優于單純ARB類藥物,其機制源于同時抑制腦啡肽酶降解利鈉肽與阻斷RAAS系統的雙重排鈉作用。在老年血壓高合并慢性腎病1-2期患者中,LCZ696醫治12周后尿微量白蛋白/肌酐比值較纈沙坦組下降28.6%,提示其腎保護作用不依賴于血壓降低幅度。對于急性心肌梗死伴心衰患者,2021年臨床研究證實LCZ696可使左室射血分數(LVEF)提升幅度達6.2%,明顯高于對照組的3.1%,且心衰再入院率降低66.7%。這種跨適應癥療效得益于其改善心肌能量代謝、抑制氧化應激的多通路作用,例如通過調節PI3K/AKT信號通路減少心肌細胞凋亡,同時增強內皮一氧化氮合酶(eNOS)活性改善血管內皮功能。美法侖直銷特色原料藥成為企業競爭新焦點。
諾拉曲特(Nolatrexed,CAS:147149-76-6)作為胸苷酸合成酶抑制劑,其重要性能源于對靶點酶的精確作用機制。胸苷酸合成酶是DNA復制過程中催化脫氧尿苷酸(dUMP)轉化為脫氧胸苷酸(dTMP)的關鍵酶,而諾拉曲特通過模擬天然底物結構,以高親和力占據酶的活性中心。其分子設計基于胸苷酸合成酶的三維晶體結構,采用計算機輔助藥物設計技術優化喹唑啉骨架,使藥物分子能夠同時結合酶的兩個葉酸結合位點,形成穩定的復合物。這種雙重結合模式不僅增強了抑制效力,還通過空間位阻效應阻止底物進入,從而徹底阻斷dTMP的合成。實驗數據顯示,諾拉曲特在體外對肝疾病細胞系的IC50值低至0.1-0.5μM,明顯低于傳統抗代謝藥物5-氟尿嘧啶(5-FU)的2-5μM范圍,表明其具有更強的細胞毒性。體內研究進一步證實,在裸鼠肝疾病移植瘤模型中,諾拉曲特以50mg/kg劑量連續給藥14天,可使疾病體積縮小65%,而同等劑量5-FU只抑制38%,凸顯其作為新一代抗疾病藥物的潛力。
2024年EHA年會公布的BOSTON研究亞組分析顯示,硼替佐米聯合卡非佐米(第二代蛋白酶體抑制劑)的雙蛋白酶體抑制方案,可使復發/難治性MM患者的中位無進展生存期(PFS)延長至22.3個月,較單藥的方案提升8個月。此外,其皮下制劑(2011年獲FDA批準)因注射部位反應發生率降低(從6%降至2%),患者耐受性明顯改善,尤其適用于靜脈通路困難者。展望未來,隨著第三代蛋白酶體抑制劑(如馬里佐米)和蛋白酶體降解劑(PROTAC技術)的研發,硼替佐米或將從醫治退居二線,但其作為突破性的藥物的歷史地位,以及在聯合醫治中的基石作用,仍將持續影響血液疾病的醫治格局。原料藥生產廢水COD值需控制在200mg/L以下,膜生物反應器處理效率超95%。
從藥代動力學特征分析,德蘭佐米的口服生物利用度達62%,明顯優于硼替佐米的35%,這得益于其優化的分子極性(LogP=2.1)和腸道吸收特性。在C57BL/6小鼠模型中,單次口服10 mg/kg后,血漿Cmax達1.2 μM,T1/2為6.8小時,較靜脈注射硼替佐米的3.2小時延長一倍。組織分布研究顯示,德蘭佐米在疾病組織的AUC0-24h是正常肌肉組織的3.7倍,這種靶向富集效應與其通過EPR(增強滲透與滯留)效應穿透疾病血管內皮密切相關。代謝穩定性方面,該化合物在肝微粒體中的半衰期為45分鐘,主要代謝產物M1(去甲基化衍生物)保留85%的母體活性,形成有效的代謝啟動循環。值得注意的是,德蘭佐米對細胞色素P450酶系的抑制作用較弱(IC50>50 μM),明顯降低藥物-藥物相互作用風險,為聯合化療方案提供安全保障。原料藥需求隨老齡化加劇不斷增長,市場發展潛力較大。諾拉曲特批發
原料藥的生產工藝優化可減少廢棄物排放,保護環境。拉薩多西他賽
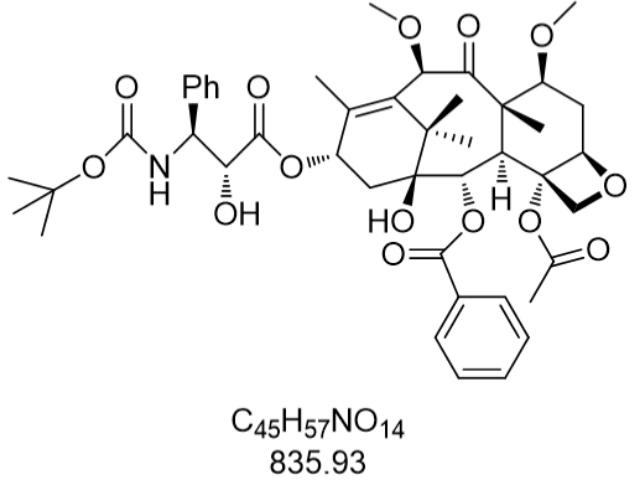
紫杉醇(Paclitaxel,CAS號:33069-62-4)作為天然抗疾病藥物的標志,其發現歷程堪稱現代醫藥研發的典范。1962年,美國農業部科學家初次從太平洋紫杉樹皮中分離出具有抗疾病活性的粗提物,但受限于當時技術條件,其化學結構直到1971年才通過X射線晶體衍射技術被完整解析。這種由47個碳原子、51個氫原子、1個氮原子和14個氧原子構成的復雜二萜生物堿,分子量達853.92,其獨特的[5.3.1]橋環結構和11個手性中心使其成為有機合成領域的珠穆朗瑪峰。1979年,科學家通過同位素示蹤技術揭示其作用機制:紫杉醇通過特異性結合聚合態微管蛋白,抑制微管解聚,導致細胞有絲分裂停滯于中期,這種微管穩定劑模式與傳統的微管解聚抑制劑形成鮮明對比。1992年,FDA批準紫杉醇注射液用于卵巢疾病醫治,標志著源自天然植物的抗疾病藥物正式進入臨床,其研發歷程被《科學》雜志評為20世紀偉大的醫學突破之一。拉薩多西他賽
- 河南4-溴-2-甲基茚 2025-12-14
- (3-(溴甲基)-1-甲苯磺酰氮雜啶-3-基)甲醇生產商 2025-12-14
- 對甲氧基苯乙胺價格 2025-12-14
- 上海N-Boc-1-氨基環丁烷羧酸 2025-12-14
- 江西紫杉醇側鏈酸(五元環) 2025-12-14
- Boc-D-丙氨醛供應報價 2025-12-14
- 磺酰二咪唑廠家直銷 2025-12-14
- 反-2-己烯醛哪里有賣 2025-12-14
- 沈陽紫杉醇側鏈中間體(3R 2025-12-14
- N-芐基甘氨酸乙酯哪家正規 2025-12-13
- 徐匯區智能易型EMA服務電話 2025-12-14
- 福建非滅活病毒采樣管病毒采樣管廠家直銷 2025-12-14
- 江西醫療植絨拭子批發 2025-12-14
- 吳中區標準干粉吸入器銷售方法 2025-12-14
- 孟津附近高性價比的醫療型養老護理院 2025-12-14
- 河南安裝低價定制義眼護理 2025-12-14
- 佛山雅德助行器價格 2025-12-14
- 黃浦區分析試劑產品 2025-12-14
- 南岸區臍帶消毒術前涂藥器價格 2025-12-14
- 江蘇可定制植絨拭子檢測 2025-12-14